即可将网页分享至朋友圈
【编前语】学校新闻中心推出“美丽成电”主题宣传报道,以全面展示成电及成电人的奋斗之美、创新之美、师德之美、奉献之美、和谐之美,进一步激发广大成电人热爱成电、建设成电、奉献成电的内生动力。
将外源分子注入单细胞以及对细胞内部做力学研究是细胞生物学的研究热点之一,但是做到这些的前提是将针尖刺入到细胞内部。然而,大量实验表明,由磷脂双分子层构成的细胞膜就像一道神奇的屏障,即便是比头发丝细一千倍的纳米针也很难刺入,成功扎透细胞膜的概率在20%到80%之间,有时候甚至怎么都扎不进去。

范娜博士
小小细胞隐藏着诸多奥秘,细胞膜究竟具有怎样的力学特性,长期令人难以捉摸。近日,我校机械与电气工程学院彭倍教授团队青年教师、中共党员范娜博士从细胞生物力学的角度,为彻底解开这个谜团带来了全新的思路,发现了纳米针尖和细胞膜相互作用时的刺入机理,并找到了两种大幅度提高“刺入率”的诀窍。
这是我校机械与电气工程学院在细胞生物力学研究领域的重要突破,其研究成果已在国际著名期刊《Small》上发表。彭倍教授团队青年教师范娜为该论文的第一作者、副教授姜海为共同第一作者,彭倍教授为论文联合通讯作者,电子科技大学机械与电气工程学院为第一作者单位和通讯作者单位。
发现科学问题:给细胞打针充满谜团
刺入活体细胞探究生命的奥秘是生命科学家的梦想,尤其是,如何给人体普遍存在的成纤维细胞注入药物、蛋白质或转录因子,以诱导这些普通的细胞变成“万能”的“诱导多能干细胞”,成为越来越强烈的需求。
“设想一下,只要取一个成纤维细胞,比如普通的皮肤细胞,就可以诱导产生干细胞,进而分化成完全没有免疫反应的全新的眼角膜、全新的皮肤、全新的器官,这将是多么奇妙的事情!”范娜说,“这项技术一旦成熟,将会为人类的生命和健康事业带来巨大的福祉。”

图1 纳米探针给细胞“扎针”
有了这种技术,人类要研发和测试新药也可以摒弃传统的、在伦理方面饱受诟病的动物活体试验方法,而是通过在体外培育特定的人体细胞组织,并放心地进行高通量的药物测试。这样既可以大大缩短测试新药的时间,也可以更加准确地了解药物的效用。
然而,细胞膜的存在给生命科学家进入细胞内部设置了一道巨大屏障。这层薄膜主要由磷脂双分子构成,厚度仅为8-10nm,具有半透性且富有流动性。在针刺方法诞生之前,要想突破这层防线,就得派遣“比针尖还小一万倍”的“特洛伊木马”,即让携带转录因子的病毒对细胞进行转染。
但是,使用病毒转染的方式存在致癌风险且转染成功的概率仅为1%,尤其是很难区分哪些细胞已被转染、哪些细胞未被转染,转染程度无法进行精确的量化控制。因此,科学家逐步探索出了无病毒、非破坏性、可量化控制的新方法,即给细胞“打针”,直接把药物、蛋白质或转录因子精准地注入单个细胞内部。
范娜在梳理学界给细胞“打针”的研究成果时发现,纳米针要刺入细胞膜并不容易,刺入效率的范围低时可至20%,高时可达80%,浮动区间很大,各不相同。虽然生物学家已经注意到这个现象,但“知其然而不知其所以然”。
因此,她敏锐地意识到,生物力学的研究方法或许可以为解释这个现象提供新的思路和科学依据,进而找到提高刺入率的有效方法,为生物学家探索细胞内部的奥秘提供理论和技术支持。
亲自动手扎针:连扎几百次发现应力变化特点
“纸上得来终觉浅,绝知此事要躬行。”给细胞扎针到底有什么样的力学特征?范娜认为,要了解这些信息,首先得自己动手扎一扎。他们所用的“纳米针”和成纤维细胞都很容购买,在实验室里完全可以重复前人的研究。
“纳米针”的学名叫做“原子力显微镜探针”(AFM tip),其针尖直径一般为20至100纳米,小到肉眼根本无法看见。这种设备十分灵敏,可以测量到很微小的力——纳牛(nN)。1纳牛等于10亿分之一牛。我们手指轻敲键盘的力约为7亿纳牛。
有了灵敏的“纳米针”,就可以开始给细胞“打针”了。他们先给“纳米针”设定一个力值“开关”,然后从针尖接触到细胞膜开始逐渐下压,加载力也因此逐渐增加,当力的大小达到“开关”位置时,“纳米针”就立马弹回来,这个力就是所谓的“触发力”。
在逐渐用力的过程中,如果细胞膜没有刺破,可以把“触发力”提高一点再刺;如果细胞膜在某个力值被刺破了,力的变化曲线就会记录下这个数值,这个数值就是“刺入力”。实验中,她分别对30个活细胞进行针刺实验,每个细胞重复刺4次,一共得到120组数据。通过统计刺入和没有刺入的力曲线,得到了“触发力”“刺入力”与“刺入率”之间的关系。
她分别测量了“触发力”为1纳牛、3纳牛、5纳牛、8纳牛时的“刺入力”,每个力值得到120组力曲线数据。通过分析、统计实验数据,她发现:“刺入力”远低于“触发力”,而且,刺入效率与“触发力”也不成正比。
从下图可以看到,当“触发力”为5纳牛时,“刺入率”达到最高的15%;再增大“触发力”,“刺入力”依然在1.3纳牛附近徘徊,“刺入率”反而下降到了12.5%。也就是说,无论加载的力道或大或小,“刺入力”总是偏向于一个比较稳定的值,不会随“触发力”的增加而增加。
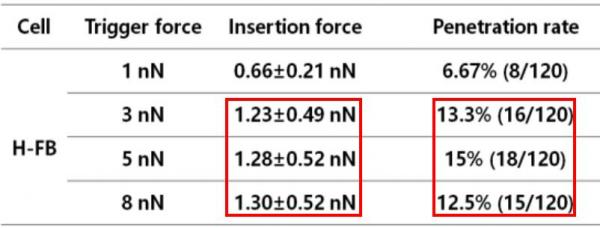
图2 细胞膜“触发力”“刺入力”与“刺入率”的关系
按照一般的理解,扎针所用的力越大,肯定越容易扎透呀!如果画一条曲线,那么,“刺入力”肯定是在“加载力”最大的时候刺破细胞膜的。然而,实验数据表明,这个“常识”是不可靠的。为什么会这样?
范娜提出了一个假说:在探针压入细胞的过程中,细胞膜的应力不是持续增加的,可能存在分段的现象,细胞膜的应力达到一定的数值就保持不变了,只有这样才能解释“刺入率”不随外界载荷增加而增加且“刺入力”远小于“触发力”的现象。
探秘细胞膜结构:“细胞膜不像皮球,更像一顶帐篷”
既然把细胞想象成“皮球”无法解释实验数据,那么,细胞膜的应力变化和细胞膜的结构特征肯定还有其他的可能。为了解释这种可能,范娜在大量实验的基础上,建立了细胞膜“骨架”模型,提出了“细胞膜应力分段效应假说”并加以实验验证。
然而,应力是“单位面积上的内力”,无法直接测量出来,因此,若要验证猜想,需要构建合适的数值模型来准确计算。而要构建数值模型,首先得了解细胞的结构。
已有的研究显示,细胞膜下有一层肌动蛋白丝,像“栅栏”一样把细胞膜分隔成许多隔室。不同类型细胞的肌动蛋白网格大小各有不同,范围从30纳米到230纳米不等。早在1983年就有生物学家拍下了摩尔比为1:50的肌动蛋白/细丝蛋白网络的电子显微镜照片。
再加上微管的支撑,细胞膜就神奇地有了“骨架”。范娜形象地比喻说,“在微管和肌动蛋白丝的支撑下,细胞其实更像一顶帐篷。”
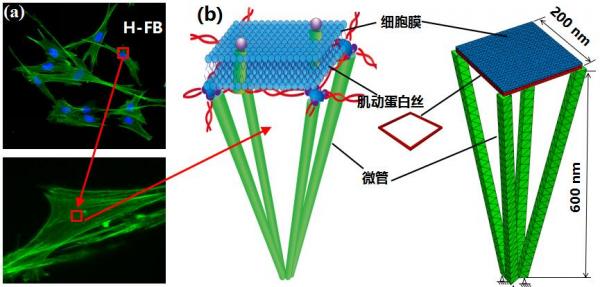
图3 细胞膜及细胞膜骨架网络结构建模
问题是,这种“骨架”结构对细胞膜应力的影响有多大?虽然在2010年已经有研究表明,细胞膜下的肌动蛋白丝可能对能否刺入十分重要,但是该项研究并没有对此作出精确的量化描述。
经过实验与有限元分析,范娜证实,由于细胞膜骨架具有网格结构,细胞膜在针刺过程中的应力呈明显的分段现象(应力分段点S)。在应力分段点S之前,细胞膜的应力增加很快,之后趋于稳定。如果细胞膜在S点之前不能刺入,就很难再刺入了。因此,要提高“穿透率”的最好方法,就是提高第一阶段细胞膜的应力。
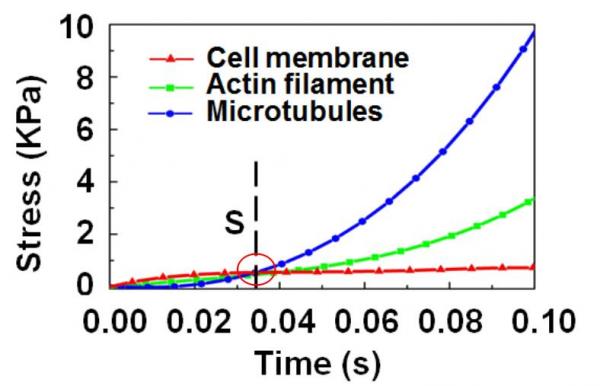
图4 细胞膜应力分段效应仿真计算(S点为应力分段点,红绿蓝曲线分别为细胞膜、肌动蛋白、微管的应力曲线)
如何提高“第一阶段细胞膜的应力”?原理其实很简单,一种方法是增加细胞膜上的表面张力,他们给细胞表面刷了一层“胶水”——“鼠尾胶原I型蛋白”,这样就把软踏踏的细胞膜绷紧了一些,更容易扎破。另一种方法是减少纳米针与细胞膜之间的接触面,通俗地说,就是让针更细、更尖锐。
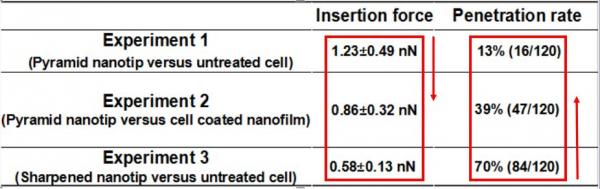
图5 三组对比实验:金字塔探针、细胞表面加胶原、纳米细针得到的“刺入力”和“刺入力”的关系
实验显示,没有经过任何处理的细胞,刺入力为1.23±0.49纳牛,“刺入率”只有13%;而给细胞涂上“胶水”之后,刺入力减小到0.86±0.32纳牛,“刺入率”却提升至39%;如果用更加尖锐的纳米针,刺入力可减小到0.58±0.13纳牛,“刺入率”高达70%。
执着的信念:“用力学方法给生物学带来了一份厚礼”
给细胞扎针的难题和谜团终于揭开,论文评阅人给出了高度的评价:“这是世界上第一次用细胞生物力学方法对细胞膜的应力给出精确的、量化的描述。”范娜从2015底年开始关注这个问题,到2018年终于做出成果,她与团队成员一起用了2年多的时间给出了科学解释。

范娜(左)与学生合影
做出这项成果并不容易。范娜是2013年来到电子科大加入彭倍教授团队的。此前,她虽然在读博期间接触过生物力学,但研究的主要是髋关节的摩擦噪声问题。深入到纳米量级研究生物力学,在人生中还是第一次。她选择了一个生物力学和纳米力学交叉的切入点,那就是细胞。
而此前,她对细胞的研究没有任何基础。因此,一切都得从零开始。“其实,我们课题组没有一个老师有细胞研究方面的学术背景,更不用说开展这种活体单细胞研究了。”她说,一切都是从零开始的:从零开始梳理文献,从零开始学习请教,从零开始寻找合作。
没有纳米细针,就找上海的某研究所加工;不懂细胞刺入方法,就去重庆大学生物工程学院寻求合作。遇到难题或瓶颈,就找彭倍教授、姜海副教授讨论,并发动团队内的博士、硕士一起想办法,进行思想碰撞、头脑风暴。
精准操控原子力显微镜给单个细胞扎针也是一个高难度的技术活。由于纳米针很细、很脆而且价格不菲,因此扎针时要求操作很稳很准,否则针头折断,买针头的钱就打水漂了。设定每一个“触发力”,都要进行预实验和正式实验,整个实验中,她给细胞扎针的次数多达成千上万次。
由于实验方案需要和合作单位共同商榷,在做实验的半年时间里,她经常往返于电子科大和重庆大学。后期的数据整理、统计和分析的工作量也很大,团队的博士生、研究生甚至本科生都积极参与了进来。论文的撰写(包括图片和图表制作),范娜和姜海副教授总共经过了32遍修改。
论文投稿后,他们共收到三位审稿人的反馈意见。其中一位审稿人高度赞扬了这项工作;另一位审稿人从论文写作的细节性问题提出了建议。还有一位审稿人从应用前景的角度提出质疑,认为纳米针价格昂贵,难以推广应用,因此该项研究意义不大。对此,范娜毫不胆怯,先后两次据理力争,向专家阐述了这项工作的重要意义,最终说服了专家。2018年5月,论文最终在《Small》上发表。
“细胞生物力学是一个交叉学科,可以破解生物学家以前遇到的许多难题,至少可以提供新的视角和方法,为生命科学的研究提供有力帮助。”范娜引用“生物力学之父”冯元桢先生的话与所有的青年学人共勉:“听从自己内心的声音,永不放弃对为未知的探索。生命不息,奋斗不止!”
编辑:林坤 / 审核:罗莎 / 发布:陈伟


